Cinq acides alpha-aminés
(2ème partie)
l'asparagine, l'acide aspartique, la leucine,
la sérine, la glycine
Sauf la glycine, tous ces acides alpha-aminés, à savoir la présence d'un groupement amine sur l'atome de carbone en C2 de la fonction acide carboxylique, ont un atome de carbone asymétrique justement en C2. C'est à dire un atome de carbone entouré de quatre atome(s) ou groupement(s) d'atomes différents. Cela entraîne l'existence de deux isomères optiques ou énantiomères notés R (ou D pour destro) et S (ou L pour levo).
Pour exemple l'asparagine a un atome de carbone en C2 entouré d'un atome d'hydrogène, d'un groupement éthanamide CH2-C(=O)NH2, d'un groupement amine NH2 et d'un groupement acide carboxylique C(=O)-OH.
1/ l'asparagine
ou acide 2,4-diamino-4-oxobutanoïque
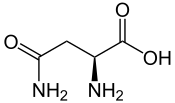
L ou S(–)-asparagine
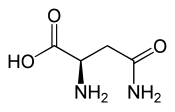
D ou R(+)-asparagine
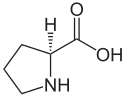
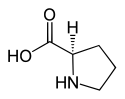
2/ l'acide aspartique
ou acide 2-aminobutanoïque

Acide L ou S(+)-aspartique

Acide D ou R(-)-aspartique
3/ la leucine
ou acide 2-amino-4-méthylpentanoïque

L ou S(+)-leucine

D ou R(–)-leucine
| Aliment pour 100 g |
Leucine contenu en g |
Leucine contenu en % des protéines tot. |
| Œuf, blanc, en poudre | 7,17 | 8,49 % |
| Soja, isolat de protéines | 6,78 | 7,67 % |
| Morue de l’Atlantique, salée | 5,11 | 8,13 % |
| Spiruline, en poudre | 4,95 | 8,61 % |
| Gruyère | 3,1 | 10,40 % |
| Escalope de veau | 2,88 | 7,96 % |
| Lait entier, en poudre | 2,58 | 9,80 % |
| Germe de blé | 1,57 | 6,78 % |
| Protéine de lactosérum (whey) | 1,19 | 9,2 % |
| Yaourt entier, nature | 0,58 | 16,71 % |
4/ la sérine
ou acide 2-amino-3-hydroxypropanoïque


L ou S(–)-sérine et D ou R(+)-sérine
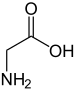
5/ la glycine
ou acide 2-aminoéthanoïque
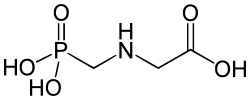
C'est le seul acide aminé qui ne soit pas une molécule chirale, car elle n'a pas de carbone asymétrique. Un analogue structurel est le glyphosate, molécule utilisée comme matière active de la plupart des pesticides désherbants totaux foliaires utilisés dans le monde.
Un analogue structurel est le glyphosate, molécule utilisée comme matière active de la plupart des pesticides désherbants totaux foliaires utilisés dans le monde. Un atome d'hydrogène de la fonction amine est substitué par un groupement phosphonométhyl CH2-P(=O)(OH)2.
Voir Alerte!!! -05- le glyphosate

/image%2F0994837%2F20210129%2Fob_647f8b_img836.jpg)


/image%2F0994837%2F20210127%2Fob_64ca84_img794.jpg)






/image%2F0994837%2F20210126%2Fob_62ac07_img795.jpg)


/image%2F0994837%2F20210126%2Fob_21ab76_img803.jpg)

/image%2F0994837%2F20210125%2Fob_43136e_img837.jpg)

/image%2F0994837%2F20210124%2Fob_35a48d_img796.jpg)
/image%2F0994837%2F20210303%2Fob_21642a_img797.jpg)
/image%2F0994837%2F20210123%2Fob_96cd80_img808.jpg)
/image%2F0994837%2F20210123%2Fob_394bb7_img804.jpg)






/image%2F0994837%2F20201203%2Fob_afca3b_img829.jpg)

/image%2F0994837%2F20201123%2Fob_5b541b_5349-18-8-1h.png)