l'équilibre céto-énolique
Les énols sont les formes tautomères des aldéhydes et des cétones énolisables (« transformables en énol »), c’est-à-dire possédant un atome d'hydrogène sur le carbone en α de la fonction carbonyle.
Ces composés carbonylés sont en équilibre avec leur forme tautomère, leur énol. On appelle cet équilibre l'équilibre céto-énolique.
Équilibre céto-énolique :
Dans la très grande majorité des cas, l'équilibre n'est pas en faveur de la forme énol; on peut même dire que la proportion de la forme énol en solution est négligeable. Cependant, dans certains cas, l'équilibre peut être déplacé dans le sens de la formation de l'énol. C'est le cas, lorsque la forme énol est stabilisée par des mésoméries, par formation de liaison hydrogène, ou par des phénomènes de conjugaison ou d'aromaticité.
Un exemple flagrant de ce dernier cas est celui du phénol, où la forme énol est ultra-majoritaire.
Équilibre céto-énolique du phénol :
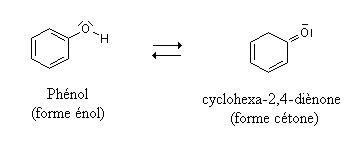
Mise en évidence:
Mode opératoire:
1ère partie: Préparations de dix solutions
avec le plus grand soin:
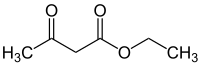
1/ solutions de 3-oxobutanoate d'éthyle ou acéto-acétate d'éthyle:
notée 1: 50 cm3 de solution 0.1 M dans du méthanol
notée 2: 50 cm3 de solution 0.3 M dans du méthanol
notée 3: 50 cm3 de solution 0.1 M dans du 2-méthylpropan-2-ol
notée 4: 50 cm3 de solution 0.3 M dans du 2-méthylpropan-2-ol
2/ solution de thiosulfate de sodium:
notée 5: 250 cm3 de solution 0.1M dans de l'eau
3/ solutions de dibrome:
notée 6: 100 cm3 de solution 0.1 M dans du méthanol
notée 7: 100 cm3 de solution 0.1 M dans du 2-méthylpropan-2-ol
4/ solutions de napht-2-ol:
notée 8: 50 cm3 de solution 1 M dans du méthanol
notée 9: 50 cm3 de solution 1 M dans du 2-méthylpropan-2-ol

5/ solution d'iodure de potassium:
notée 10: 50 cm3 de solution 0.5 M dans de l'eau.
2ème partie: Manipulations:
2-1 solution de 3-oxobutanoate d'éthyle notée 1:
Mesurer dans deux éprouvettes une notée A 15 cm3 de la solution 6 et l'autre notée B 3 cm3 de napht-2-ol de la solution 8.
Prélever 10 cm3 de la solution 1 et verser dans un erlenmeyer de 100 cm3.
Agiter avec un barreau aimanté et verser le contenu de l'éprouvette A.
Au bout de 30 secondes, ajouter le contenu de l'éprouvette B puis 3 cm3 de la solution 10. Agiter avec le barreau aimanté pendant 15 minutes.
Titrer avec la solution 5 versée dans une burette de 50 cm3. L'équivalence a lieu quand la coloration du diiode disparait.
2-2 solution de 3-oxobutanoate d'éthyle notée 2:
Mesurer dans deux éprouvettes une notée A 15 cm3 de la solution 6 et l'autre notée B 3 cm3 de napht-2-ol de la solution 8.
Prélever 10 cm3 de la solution 2 et verser dans un erlenmeyer de 100 cm3.
Agiter avec un barreau aimanté et verser le contenu de l'éprouvette A.
Au bout de 30 secondes, ajouter le contenu de l'éprouvette B puis 3 cm3 de la solution 10. Agiter avec le barreau aimanté pendant 15 minutes.
Titrer avec la solution 5 versée dans une burette de 50 cm3. L'équivalence a lieu quand la coloration du diiode disparait.
2-3 solution de 3-oxobutanoate d'éthyle notée 3:
Mesurer dans deux éprouvettes une notée C 15 cm3 de la solution 7 et l'autre notée D 3 cm3 de napht-2-ol de la solution 9.
Prélever 10 cm3 de la solution 3 et verser dans un erlenmeyer de 100 cm3.
Agiter avec un barreau aimanté et verser le contenu de l'éprouvette A.
Au bout de 30 secondes, ajouter le contenu de l'éprouvette B puis 3 cm3 de la solution 10. Agiter avec le barreau aimanté pendant 15 minutes.
Titrer avec la solution 5 versée dans une burette de 50 cm3. L'équivalence a lieu quand la coloration du diiode disparait.
2-4 solution de 3-oxobutanoate d'éthyle notée 4:
Mesurer dans deux éprouvettes une notée C 15 cm3 de la solution 7 et l'autre notée D 3 cm3 de napht-2-ol de la solution 9.
Prélever 10 cm3 de la solution 4 et verser dans un erlenmeyer de 100 cm3.
Agiter avec un barreau aimanté et verser le contenu de l'éprouvette A.
Au bout de 30 secondes, ajouter le contenu de l'éprouvette B puis 3 cm3 de la solution 10. Agiter avec le barreau aimanté pendant 15 minutes.
Titrer avec la solution 5 versée dans une burette de 50 cm3. L'équivalence a lieu quand la coloration du diiode disparait.
2-5 principe de la méthode:
La molécule de dibrome réagit plus rapidement sur la forme énolique que sur la forme cétonique.
Une augmentation de la polarité du solvant (méthanol = 33 et 2-méthylpropan-2-ol = 11) favorise la forme cétonique (méthanol = 7% d'énol et 2-méthylpropan-2-ol = 13 % d'énol).

/image%2F0994837%2F20210423%2Fob_7613a3_img921.jpg)



/image%2F0994837%2F20210427%2Fob_49e169_img923.jpg)
/image%2F0994837%2F20210427%2Fob_db4f1c_img924.jpg)
/image%2F0994837%2F20210421%2Fob_f67c3f_img919.jpg)





/image%2F0994837%2F20210407%2Fob_b35c51_img917.jpg)

/image%2F0994837%2F20210511%2Fob_29f62a_img-60.gif)

/image%2F0994837%2F20210329%2Fob_4d6829_img-1.gif)


/image%2F0994837%2F20210401%2Fob_0a5538_img914.jpg)
/image%2F0994837%2F20210330%2Fob_144e92_img912.jpg)
/image%2F0994837%2F20210330%2Fob_2ee4e2_img913.jpg)